Enlace Químico
| Enlaces entre átomos |
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces químicos. ¿Por qué se unen los átomos? Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los átomos de los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos. Distintos tipos de enlaces 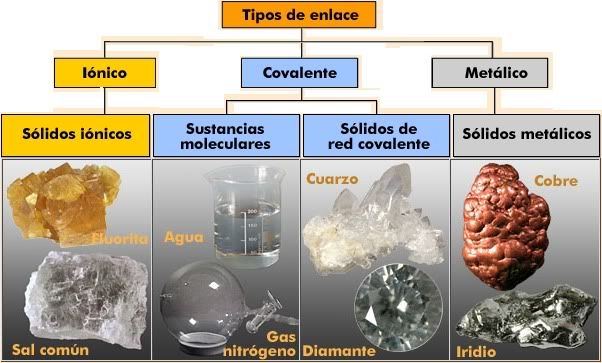 Enlace iónico |
Se produce cuando átomos de elementos metálicos se encuentran con átomos no metálicos. Los átomos del metal ceden electrones a los átomos del no metal, transformándose eniones positivos y negativos. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
Enlace covalente
| Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos. Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienden a ganar electrones para adquirir la estabilidad de la estructura electrónica de gas noble. Los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto. El enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, adquiriendo la estructura electrónica de gas noble. Así se forman normalmente las moléculas.
|
Esto es un resumen, pero aquí dejo la página para que esteis informados y para que practiquéis en casa porque también lleva actividades: http://goo.gl/Tq0AkT
Aquí dejo otra página por si os interesa construir átomos y conocer más sobre este tema: http://goo.gl/2nb8gh
Otra página distinta con otra explicación diferente para más información: http://goo.gl/33qMyb