Blog Portfolio de Ampliacion Fisica y Quimica
miércoles, 15 de noviembre de 2017
viernes, 10 de junio de 2016
REACCIONES QUÍMICAS
Reacciones Químicas
Espuma que arde:
Cubrir un clavo de hierro de cobre:
Neutralización ácido-base:
Cómo hacer queso casero:
martes, 1 de marzo de 2016
ENLACE QUÍMICO
Enlace Químico
| Enlaces entre átomos |
Prácticamente todas las sustancias que encontramos en la naturaleza están formadas por átomos unidos. Las intensas fuerzas que mantienen unidos los átomos en las distintas sustancias se denominan enlaces químicos. ¿Por qué se unen los átomos? Los átomos se unen porque, al estar unidos, adquieren una situación más estable que cuando estaban separados. Esta situación de mayor estabilidad suele darse cuando el número de electrones que poseen los átomos en su último nivel es igual a ocho, estructura que coincide con la de los gases nobles.Podemos explicar la unión de los átomos para formar enlaces porque con ella consiguen que su último nivel tenga 8 electrones, la misma configuración electrónica que los átomos de los gases nobles. Este principio recibe el nombre de regla del octeto y aunque no es general para todos los átomos, es útil en muchos casos. Distintos tipos de enlaces 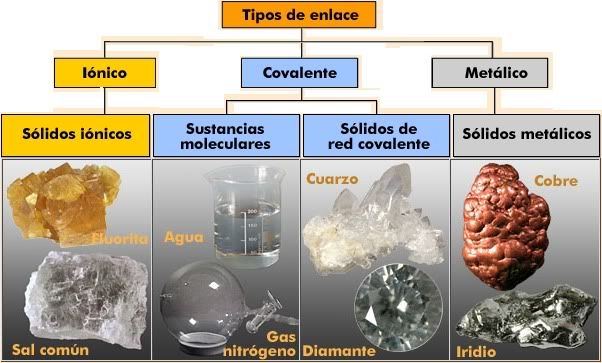 Enlace iónico |
Se produce cuando átomos de elementos metálicos se encuentran con átomos no metálicos. Los átomos del metal ceden electrones a los átomos del no metal, transformándose eniones positivos y negativos. Al formarse iones de carga opuesta éstos se atraen por fuerzas eléctricas intensas, quedando fuertemente unidos y dando lugar a un compuesto iónico. Estas fuerzas eléctricas las llamamos enlaces iónicos.
Enlace covalente
| Los enlaces covalentes son las fuerzas que mantienen unidos entre sí los átomos no metálicos. Estos átomos tienen muchos electrones en su nivel más externo (electrones de valencia) y tienden a ganar electrones para adquirir la estabilidad de la estructura electrónica de gas noble. Los átomos no metálicos no pueden cederse electrones entre sí para formar iones de signo opuesto. El enlace se forma al compartir un par de electrones entre los dos átomos, uno procedente de cada átomo. El par de electrones compartido es común a los dos átomos y los mantiene unidos, adquiriendo la estructura electrónica de gas noble. Así se forman normalmente las moléculas.
|
Esto es un resumen, pero aquí dejo la página para que esteis informados y para que practiquéis en casa porque también lleva actividades: http://goo.gl/Tq0AkT
Aquí dejo otra página por si os interesa construir átomos y conocer más sobre este tema: http://goo.gl/2nb8gh
Otra página distinta con otra explicación diferente para más información: http://goo.gl/33qMyb
TABLA PERIÓDICA
Tabla Periódica
Una de las tablas periódicas interactivas que hay es la tabla periódica de los elementos, aquí dejo su enlace: http://goo.gl/o5K7jQ
viernes, 12 de febrero de 2016
SI EL I.E.S ARZOBISPO LOZANO FUERA LA TIERRA
SI EL ARZOBISPO FUERA LA TIERRA.
1. Presentación.
Vamos a meter el Sistema Solar siendo la Tierra nuestro instituto "Arzobispo Lozano" y Murcia siendo Plutón.
Para ello tenemos que hacer los siguientes cálculos:
También vamos ha poner dos estrellas que son el Sol y Alfa Centauri y sus cálculos son los siguientes:
A continuación hacemos un tutorial en forma de vídeo donde utilizando la aplicación de Google Maps y el Paint podamos meter el Sistema Solar entre la distancia de Jumilla a Murcia. Este es nuestro vídeo:
2. Programas de astronomía.
Podemos encontrar programas de astronomía en nuestro ordenador como por ejemplo:
- Stellarium: http://goo.gl/A2izb8
- Starry Night: http://goo.gl/T4nAWN
- Google earth: https://goo.gl/5F96lK
- Celestia: http://goo.gl/E8PmGs
- Cartes du ciel: http://goo.gl/vcniuI
- Solar System Scope: https://goo.gl/BMq6yr o http://goo.gl/4a8HVZ
3. Aplicaciones de Astronomía.
También podemos encontrar aplicaciones en nuestro teléfono como por ejemplo:
- Android: SkEye-Astronomy, Mapa Estelar, Stellarium Mobile Planetario (es de pago).
- Apple: Mapa Estelar, Solar Walk Free - Planets of the Solar System, Redshift - Astronomía (es de pago).
jueves, 11 de febrero de 2016
BARÓMETRO CASERO
BARÓMETRO CASERO
1. ¿Qué es y para que se utiliza?
Para poder comenzar a gastar nuestro barómetro primero tenemos que hacer una escala, aquí dejamos los pasos de como lo hemos echo nosotras en el siguiente enlace: https://goo.gl/fmQp9i
Primer día 12 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1010 hPa(mb) y nuestro barómetro casero nos dio el mismo resultado.
1. ¿Qué es y para que se utiliza?
Es un instrumento para medir la presión atmosférica. Detecta la presión ejercida por la atmósfera sobre un punto determinado que gracias a ello se pueden predecir con seguridad los cambios meteorológicos.
2. Tutorial explicando cómo se hace el barómetro.
En el siguiente vídeo se puede ver como hemos hecho nuestro barómetro casero.
El vídeo lo hemos hecho Estefanía Plá, María Consuelo Poveda y Evelin Abigail Capuz.
Para poder comenzar a gastar nuestro barómetro primero tenemos que hacer una escala, aquí dejamos los pasos de como lo hemos echo nosotras en el siguiente enlace: https://goo.gl/fmQp9i
3. Otros instrumentos usados en meteorología.
Podemos ver en esta página web ClimaTIC en el apartado de elementos del clima cuatro ejemplos de instrumentos como puede ser:
- El pluviómetro que se utiliza para medir las precipitaciones.
- El heliógrafo que con él podemos ver el tiempo que el cielo ha estado cubierto de nubes.
- El anemómetro que con él podemos ver a la velocidad que va el viento.
También podemos ver más instrumentos en esta página web Instrumentos meteorológicos como por ejemplo:
- La veleta que sirve para medir la dirección del viento.
- El termómetro que mide la temperatura.
- El higrómetro que mide la humedad del aire e indica la cantidad de vapor de agua que contiene.
4. Probamos nuestro barómetro.
Vamos hacer un seguimiento de una semana con nuestro barómetro y lo compararemos con la página web de MeteoJumilla. Miraremos la presión y las nubes.
- Segundo día 13 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1007 hPa(mb) y nuestro barómetro casero nos dio el mismo resultado.
- Tercer día 14 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1000 hPa(mb) y nuestro barómetro casero nos dio 998mb.
- Cuarto día 15 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1004 hPa(mb) y nuestro barómetro casero nos dio 1005mb.
- Quinto día 16 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1020 hPa(mb) y nuestro barómetro casero nos dio el mismo resultado.
- Sexto día 17 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1020 hPa(mb) y nuestro barómetro casero nos dio el mismo resultado.
- Séptimo día 18 febrero 2016: como podemos ver, la página de MeteoJumilla nos indica que hay 1019 hPa(mb) y nuestro barómetro casero nos dio el mismo resultado.
¡Después de una semana hemos comprobado que nuestro barómetro va perfectamente!
jueves, 21 de enero de 2016
Experimento Casero.
EXPERIMENTO
Este vídeo esta realizado por: María Consuelo, Estefanía y Evelin Abigail.
Suscribirse a:
Comentarios (Atom)








